Líneas de investigación
- Home
- Líneas de investigación
Nuestra
Misión
La investigación en el GQOM se centra en el diseño, la síntesis y la validación preclínica de entidades químicas de origen sintético o de origen natural, con el objetivo final de posicionar dichos productos farmacéuticos novedosos en la clínica.
Para llevar a cabo esto, nos involucramos en esfuerzos de investigación interdisciplinarios que unen la química y la biología.
Nuestro enfoque actual se puede agrupar en dos áreas principales: (i) I+D de entidades químicas con énfasis en diagnóstico y terapia de cáncer; ii) I+D de fármacos antitripanosomatídeos.
Nuestro laboratorio brinda un entorno de formación y capacitación confortable tanto para estudiantes de pre-grado como para investigadores de posgrado.
Si está interesado en unirse al grupo, puede consultar al e-mail de contacto y nos pondremos en contacto a la brevedad.
Desarrollo de entidades químicas de alto contenido en boro para su aplicación en cáncer a través de Terapia por Captura Neutrónica de Boro
La BNTC (por sus siglas en inglés Boron Neutron Capture Therapy) es una forma experimental de radioterapia en cáncer que tiene la característica única de administrar la dosis de radiación selectivamente a nivel celular.
La terapia emplea dos elementos: los neutrones y el nucleido estable de boro 10B. Los neutrones son obtenidos de fuentes como un reactor nuclear o un acelerador de partículas específico.
El boro es una sustancia inocua, inerte y muy estable que está presente en la naturaleza. En la práctica, esta terapia consiste en suministrar al paciente un compuesto químico que ha sido diseñado para ser selectivamente incorporado por las células de cáncer y que deberá de contener es su estructura al elemento 10B.
Una vez incorporado por la célula tumoral, convierte a estas en la ‘diana’ perfecta para que la radiación con neutrones las ataque.
De este modo se consigue atacar zonas muy localizadas y eliminar esas células tumorales, logrando que se minimice así el daño a las células adyacentes, presumiblemente sanas.

Diseño y síntesis de inmunoconjugados marcados para imagenología y terapia de cáncer
Los últimos años han sido testigos de un aumento increíble en el uso de inmunoconjugados para el diagnóstico y la terapia del cáncer.
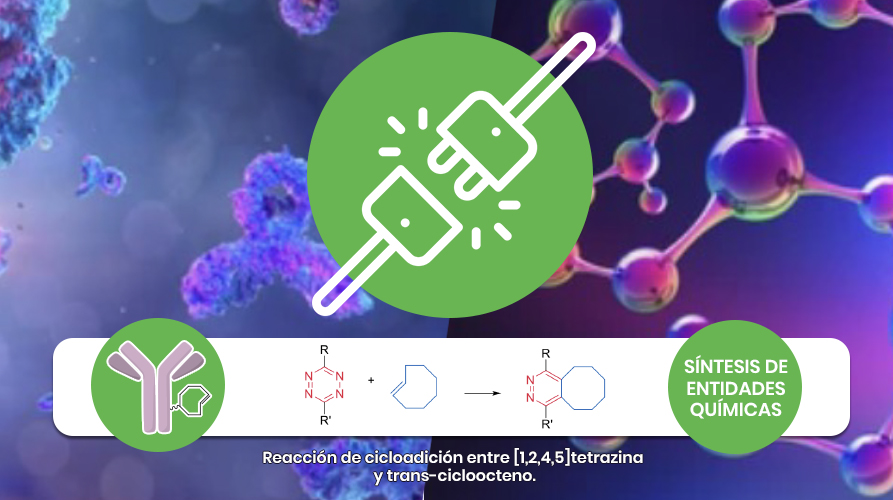
En nuestro grupo, y en colaboración con investigadores nacionales e internacionales, hemos estado explorando el uso de la reacción bioortogonal de Diels-Alder de demanda inversa de electrones como herramienta de bioconjugación para la química radiofarmacéutica.
En una serie de trabajos científicos publicados, hemos detallado el desarrollo de una estrategia de pretargeting in vitro e in vivo basada en la reacción rápida y selectiva entre el trans-cicloocteno y una [1,2,4,5]tetrazina.
En este sentido nos hemos enfocado en la síntesis de nuevos derivados [1,2,4,5]tetrazina acoplados a distintos entidades químicas con el objetivo de generar tanto derivados unidos a farmacóforos, así como también derivados radiomarcados.
De esta forma exploraremos nuevos escenarios para aplicar la reacción de cicloadición tanto para estrategias pretargteting como herramienta de conjugación modular con aplicación en imagenología y terapia.

Búsqueda de nuevas herramientas quimioterapéuticas para enfermedades desatendidas
Ciertas enfermedades, como las tripanosomiasis y las leishmaniosis, resultan ser para las industrias farmacéuticas un deprimido mercado económico debido a los escasos recursos de la población que las padecen.
Por tal motivo, se las conoce como enfermedades desatendidas. Sin embargo, desde el sector académico se realizan múltiples esfuerzos, ya sea explicando la biología de los organismos involucrados como identificando potenciales agentes terapéuticos.
En ese sentido, desde hace casi 30 años nuestro grupo ha trabajado en la identificación de nuevas entidades químicas capaces de transformarse en fármacos para tripanosomiasis y leishmaniosis.
Así, hemos trabajado en compuestos de síntesis y compuestos naturales. Actualmente, además de la síntesis de compuestos que puedan presentar mecanismos de acción específicos, se está trabajando en el estudio del uso de la polifarmacología (combinación de fármacos) y en el reposicionamiento de fármacos (empleo en nuevas patologías de agentes descritos para otras enfermedades) como herramientas quimioterapéuticas para tripanosomiasis y leishmaniosis.
Desarrollo de fluoróforos para su uso como LysoTracker y nuclei-tracker y síntesis de heterociclos carbenoides de Ni(II) con un alto ICT para su uso como fotocatalizadores
La transferencia de carga intramolecular (ICT) es un proceso asociado con un movimiento electrónico bajo excitación desde el grupo donador al grupo aceptor a través de un cadena conjugada.
El concepto juega un importante rol en ramas de la química, biología y física para el diseño de materiales tales como OLEDs, celdas solares, celdas fotovoltaicas, emisores de diodos, sensores ópticos, fotocatalizadores para reacciones químicas y sensores para “live-cell imaging”.
Desde 2020 hemos venido estudiando mediante colaboraciones nacionales e internacionales este tipo de mecanismo con un abordaje tanto experimental como teórico identificando algunas plataformas para su aplicación en química y biología.
Proyectos de investigación
financiados en los últimos años
- 1- Desde el Erlotinib hacia Carbabotinib: Inhibidores de EGFR basado en clúster de boro. FCE_3_2018_1_148288.
- 2- Estudio de sistemas de administración de agentes terapéuticos dirigidos a PD-L1. FCE_3_2020_1_162319.
- 3- En búsqueda de tratamientos efectivos y seguros para enfermedades parasitarias desatendidas: Chagas y leishmaniasis visceral. FCE_3_2022_1_172684.
- 4- Cribado fenotípico en la búsqueda de agentes anti-COVID19”. Programa Conocimiento especializado para enfrentar la emergencia planteada por el COVID 19 y sus impactos, CSIC-UdelaR.
- 5. - Síntesis Nacional de Favipiravir. Programa Conocimiento especializado para enfrentar la emergencia planteada por el COVID 19 y sus impactos, CSIC-UdelaR.
- 6- Búsqueda de un conveniente fotocatalizador de Ni (II) basado en carbeno N-heterociclico para un acoplamiento cruzado carbono-nitrógeno bajo condiciones suaves. CSIC-I+D-UdelaR.
- 7- Realzando las interacciones hidrofóbicas mediante la incorporación de un farmacóforo emergente en un sistema químico inhibidor de tirosina quinasa. Despegue Científico 2023-Pedeciba Química.
Principales publicaciones
del grupo
Dávila, B., Vignolo, P., Silvarrey, M., Benítez, A., González Schmidt, J., de Arteaga Guidotti, C., García, M. F., Cerecetto, H., Couto, M. (2025) Structure-Activity Relationships of closo- and nido-Carborane Erlotinib Analogs: Lipophilicity as a Key Modulator of Anti-Glioma Activity. Pharmaceuticals 18(11), 1753. DOI: 10.3390/PH18111753
Dávila, B., Vignolo, P., González, I., et al. (2025) Escaping from Flatland: 3D Carborane-Based Bioisosteres of Erlotinib as Potential Anticancer Agents. ACS Omega 10(42), 50468–50487. DOI: 10.1021/ACSOMEGA.5C07982
Couto Sire, M. M., Vignolo Yaffé, P. J., Aguilera López, E. P., Silvarrey Capeche, M., López Arebalo, D. C., Cerretto Meyer, H. E. (2025) Implementación de instancias de aprendizaje-enseñanza en inglés en Química Orgánica I de la Universidad de la República de Uruguay. Revista Científica Multidisciplinaria Ogma 4(2), 99–115. DOI: 10.69516/PM87VS90
Veira, C., Benítez, D., Pérez-Díaz, L., Álvarez, G., Cerecetto, H., Aguilera, E. (2025) Looking for approved-medicines to be repositioned as anti-Trypanosoma cruzi agents: identification of new chemotypes with good individual- or in combination-biological behaviours. Memórias do Instituto Oswaldo Cruz 120, e240183. DOI: 10.1590/0074-02760240183
Gotopo, L. A., Cabrera, G., Romero, A. H. (2025) Estimation of the nucleophilic α- and their relative β-, γ- and δ-effects in solution through fluorometry. Journal of Photochemistry and Photobiology A: Chemistry 462, 116239. DOI: 10.1016/J.JPHOTOCHEM.2024.116239
Gotopo, L. A., Güida, J. A., Echeverría, G., Piro, O. E., Romero, I. E., Castelli, R., Cabrera, G., Cabral, P., Cerecetto, H., Romero, A. H. (2025) Molecular recognition of halogen-bond of diiodine with an ambidentate ligand: fluorometry as lead strategy for analysis in solution. Journal of Molecular Structure 1322, 140320. DOI: 10.1016/J.MOLSTRUC.2024.140320
Romero, A. H., Gonzalez, K. N., Sabino, M. A. (2025) Application of nano and microformulations to improve the leishmanicidal response of quinoline compounds: a brief review. Frontiers in Chemistry. DOI: 10.3389/FCHEM.2025.1622566
Dávila, B., Fló, M., Ruatta, S., Lorenzelli, F., Medeiros, A., Bastidas, J., Rodríguez, G., Aguilera, E., García, M.F., Romero, A.H., Park, S., Heo, J., Lee, H., Jeon, Y., Park, K.P., Shum, D., López, V., Couto, M., Cerecetto, H., Comini, M.A. (2025) Unveiling Novel Pharmacophores and Hit Compounds for the Development of Anti-virals to Treat Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Bioorganic Chemistry 163, 108724. DOI: 10.1016/j.bioorg.2025.108724
Avanzo, R. E., García Liñares, G., Rodríguez, N., Romero, A. H. (2025) A comprehensive revision on the use of quinoline antimalarial drugs as leishmanicidal agents. Frontiers in Chemistry. DOI: 10.3389/FCHEM.2025.1608340
Del Carpio, E., Hernández, L., Lubes, V., Jourdan, F., Cerecetto, H., Scalese, G., Gambino, D., Romero, A. H. (2025) Current developments of metal- and metalloid-based quinoline compounds as leishmanicidal agents. Frontiers in Chemistry. DOI: 10.3389/FCHEM.2025.1586044
Delgado, F., Benítez, A., Gotopo, L., Romero, A. H. (2025) 4-Aminoquinoline: a comprehensive review of synthetic strategies. Frontiers in Chemistry. DOI: 10.3389/FCHEM.2025.1553975
Romero, A. H., Delgado, F. (2025) 4-Aminoquinoline as a privileged scaffold for the design of leishmanicidal agents: structure–property relationships and key biological targets. Frontiers in Chemistry. DOI: 10.3389/FCHEM.2024.1527946
Couto, M., Cerecetto, H. (2024) Advancements in the Synthesis and Biological Properties of Carboranes and High-Boron Related Compounds: A Comprehensive Exploration with Emphasis on BNCT Applications. Journal of the Brazilian Chemical Society 35(10), e-20240109. DOI: 10.21577/0103-5053.20240109
Duarte, L. V. A., Silva, M. C., Pinheiro, V. S. T., et al. (2024) Enzymatic synthesis of austroeupatol esters with enhanced antiprotozoal activity. ACS Medicinal Chemistry Letters 15(6), 873–878. DOI: 10.1021/ACSMEDCHEMLET.4C00070.
Fuentes, G., Romero, I. E., Moller, M. N., Couto, M., Romero, A. H. (2024) Photoproperties of favipiravir and its 6-substituted analogues: fluorescence controlled through halogen substitution and tautomerism. Organic & Biomolecular Chemistry 22, 3910–3925. DOI: 10.1039/D4OB00397G
González, K., Medina, E., Aguilera, E., González, G., Sabino, M. A., Romero, A. H. (2024) In vitro anti-trypanosomal activity of 3-(aryl)-6-piperazin-1,2,4-triazolo[3,4-a]phthalazines-loaded ultrathin polymeric particles: effect of polymer type and particle size. RSC Pharmaceutics 1, 108–120. DOI: 10.1039/D3PM00002H.
Ferrer-Ugalde, A., Muñoz-Juan, A., Laromaine, A., Curotto, P., Nievas, S., Dagrosa, M. A., Couto, M., Núñez, R. (2025) Enhancing Boron Neutron Capture Therapy (BNCT) with Materials Based on COSAN-Functionalized Nanoparticles. Pharmaceuticals 18(4), 466. DOI: 10.3390/PH18040466
García Barcelo, G., Romero, A. H., Rodríguez-Piñón, M. G., Cerecetto Meyer, H. (2024) In Vitro Study of Carbetocin, an Oxytocin Receptor Agonist, and 4-Phenylfuroxan-3-Carbonitrile, a NO-Releasing Agent, as Cervical Dilatators in Sheep. SSRN Electronic Journal. DOI: 10.2139/SSRN.5013670
Elizalde, V., Mirazo, S., Romero, A. H., Álvarez, G. (2024) In vitro antiviral activity of favipiravir and its 6- and 3-O-substituted derivatives against coronavirus: acetylation leads to improvement of antiviral activity. Archiv der Pharmazie 357(1), e2300494. DOI: 10.1002/ARDP.202300494
Rodríguez, G., Fernández, M., Cabrera, M., Tassano, M., Cabral, P., Couto, M., Cerecetto, H., García, M. F. (2023) Looking for New [1,2,4,5]Tetrazines to Produce <sup>99m</sup>Tc-Labelled Derivatives, with a Suitable Lipophilicity Balance for Use in Bioorthogonal Reactions. Stuttgart Journal of Chemistry – Synthetic and Laboratory Chemistry (or Selected Chemistry depending on official abbreviation). DOI: 10.1002/SLCT.202302961.
Romero, A. H. (2023) C–H Bond Functionalization of N-Heteroarenes Mediated by Selectfluor. Topics in Current Chemistry 381, 29. DOI: 10.1007/S41061-023-00437-6.
Rodríguez, G., Fernández, M., Cabrera, M., Tassano, M., Cabral, P., Couto, M., Cerecetto, H., García, M.F. (2023) Looking for New [1,2,4,5]Tetrazines to Produce 99mTc-Labelled Derivatives, with a Suitable Lipophilicity Balance for Use in Bioorthogonal Reactions. DOI: 10.1002/slct.202302961
Alamón, C., Dávila, B., García, M. F., Nievas, S., Dagrosa, M. A., Thorp, S., Kovacs, M., Trias, E., Faccio, R., Gabay, M., Zeineh, N., Weizman, A., Teixidor, F., Viñas, C., Gavish, M., Cerecetto, H., & Couto, M. (2023). A potential boron neutron capture therapy agent selectively suppresses high-grade glioma: In vitro and in vivo exploration. Molecular pharmaceutics, 20(5), 2702–2713.
Alamón, C., Dávila, B., Cerecetto, H., & Couto, M. (2023). Exploring the cell death mechanisms of cytotoxic [1,2,3]triazolylcarborane lead compounds against U87 MG human glioblastoma cells. Chemical biology & drug design, 101(6), 1435–1445.
Casanova, G., Rosillo, J. C., Jiménez, M., Fernández, A., Rodao, M., Martínez, G., Isasi, E., Presa Gau, N., Otero, G., Cabrera, M., Díaz-Amarilla, P., Cerecetto, H., González, M., & Olivera-Bravo, S. (2023) Morphological evidence of the protective effects of a synthetic chalcone against the striatal myelin damage induced by glutaric acid. International journal of developmental neuroscience. 83(3), 274-296.
Fuentes, G., García, M. F., Cerecetto, H., Álvarez, G., Couto, M., & Romero, A. H. (2023). One-step synthesis of favipiravir from Selectfluor® and 3-hydroxy-2-pyrazinecarboxamide in an ionic liquid. Organic & biomolecular chemistry, 21(17), 3660–3668.
Romero, A. H., Cabrera, G., Cerecetto, H., Gotopo, L., Davila, B., & Aguilera, E. (2023) Optimization on the 2-Arylquinazoline-4(3H)one scaffold for an selective and potent antitrypanosomal agent: Mechanism of action modulated through chemical functionalization. RSC medicinal chemistry. DOI: 10.1039/D3MD00243H
Romero, A. H., Fuentes, G., Suescun, L., Piro, O., Echeverría, G., Gotopo, L., Pezaroglo, H., Álvarez, G., Cabrera, G., Cerecetto, H., & Couto, M. (2023). Tautomerism and rotamerism of favipiravir and halogenated analogues in solution and in the solid state. The journal of organic chemistry. DOI: 10.1021/acs.joc.3c00777
Romero, A. H., Gotopo, L., Cabrera, G., & Cerecetto, H. (2023). Exploring binding chemistry of alkali/alkaline earth cations in solution through modulation of intramolecular charge-transfer in an excited ambidentate organic fluorophore. Physical chemistry chemical physics: PCCP, 25(23), 16030–16047.
Aguilera, E., Sánchez, C., Cruces, M. E., Dávila, B., Minini, L., Mosquillo, F., Pérez-Díaz, L., Serna, E., Torres, S., Schini, A., Sanabria, L., Vera de Bilbao, N. I., Yaluff, G., Zolessi, F. R., Ceilas, L. F., Cerecetto, H., & Alvarez, G. (2022). Preclinical studies and drug combination of low-cost molecules for Chagas disease. Pharmaceuticals (Basel, Switzerland), 16(1), 20.
Giglio, J., Fernandez, S., Martinez, A., Zeni, M., Reyes, L., Rey, A., & Cerecetto, H. (2022) Glycogen synthase kinase-3 maleimide inhibitors as potential PET-tracers for imaging Alzheimer’s disease: 11C-Synthesis and in vivo proof of concept. The journal of medicinal chemistry, 65(2), 1342-1351.
Paulino, M., Espinosa-Bustos, C., Bertrand, J., Cabezas, D., Mella, J., Dávila, B., Cerecetto, H., Ballesteros-Casallas, A,, & Salas, C,O. (2022) Development of 3D-QSAR and pharmacophoric models to design new anti-Trypanosoma cruzi agents based on 2-aryloxynaphthoquinone scaffold. SAR QSAR in environmental research, 33(9), 701-728.
Romero, A. H., & Cerecetto, H. E. (2022). High CT-fluorophore featuring a basic moiety into D-A chain as a pKa probe. The journal of organic chemistry, 87(12), 7618–7634.
Romero, A. H., Aguilera, E., Gotopo, L., Charris, J., Rodríguez, N., Oviedo, H., Dávila, B., Cabrera, G., & Cerecetto, H. (2022). Synthesis and antitrypanosomal and mechanistic studies of a series of 2-arylquinazolin-4-hydrazines: A hydrazine moiety as a selective, safe, and specific pharmacophore to design antitrypanosomal agents targeting NO release. ACS omega, 7(50), 47225–47238.
García, MF., de Souza Junqueira, M., Mororó, J., Camacho, X., Faria, P., C. Carneiro, G., Gallazzi, F., Chammas, R., Quinn, T., Cabral, P., & Cerecetto, H. (2021). Radio- and fluorescent-labeling of Rituximab based on the inverse electron demand Diels-Alder reaction, ChemistrySelect. 6(8), 1894.
Gonçalves, G. A., Cerecetto, H., Poser, G. L. V., Canto, R. F. S., & Eifler-Lima, V. L. (2021) Chagas disease and coumarins: A review of natural and synthetic coumarins as anti-Trypanosoma cruzi agents. Mini review in medicinal chemistry, 21(13), 1701-1717.
Lecot, N., Dávila, B., Sánchez, C., Fernández, M., González, M., Cabral, P., Cerecetto, H., & Glisoni, R. (2021) Development and evaluation of 2-amino-7-fluorophenazine 5,10-dioxide polymeric micelles as antitumoral agents for 4T1 breast cancer. Polymers (Basel), 14(1), 71.
Matiadis, D., Saporiti, T., Aguilera, E., Robert, X., Guillon, C., Cabrera, N., Pérez-Montfort, R., Sagnou, M., & Alvarez, G. (2021). Pyrazol(in)e derivatives of curcumin analogs as a new class of anti-Trypanosoma cruzi agents. Future medicinal chemistry, 13(8), 701–714.
Perdomo, C., Aguilera, E., Corvo, I., Faral-Tello, P., Serna, E., Robello, C., Wilkinson, S. R., Yaluff, G., & Alvarez, G. (2021). Preclinical studies in anti-trypanosomatidae drug development. Pharmaceuticals (Basel, Switzerland), 14(7), 644.
Rivas, F., Medeiros, A., Quiroga, C., Benítez, D., Comini, M., Rodríguez-Arce, E., Machado, I., Cerecetto, H., & Gambino, D. (2021) New Pd-Fe ferrocenyl antiparasitic compounds with bioactive 8-hydroxyquinoline ligands: a comparative study with their Pt-Fe analogues. Dalton transactions, 50(5), 1651-1665.
Romero, A. H., Romero, I. E., Piro, O. E., Echeverría, G. A., Gotopo, L. A., Moller, M. N., Rodríguez, G. A., Cabrera, G. J., Castro, E. R., López, S. E., & Cerecetto, H. (2021) Photo-induced partially aromatized intramolecular charge transfer. The journal of physical chemistry B., 125(32), 9268-9285.
Alamón, C., Dávila, B., García, M. F., Sánchez, C., Kovacs, M., Trias, E., Barbeito, L., Gabay, M., Zeineh, N., Gavish, M., Teixidor, F., Viñas, C., Cerecetto, H., & Couto, M. (2020). Sunitinib-containing carborane pharmacophore with the ability to inhibit tyrosine kinases receptors FLT3, KIT and PDGFR-β, exhibits powerful in vivo anti-glioblastoma activity. Cancers, 12(11), 3423.
Barriga-González, G., Aliaga, C., Chamorro, E., Olea-Azar, C., Norambuena, E., Porcal, W., González, M., & Cerecetto H. (2020). Synthesis and evaluation of new heteroaryl nitrones with spin trap properties. RSC advances, 10(66), 40127-40135.
Bürgi, M., Hernández, P., Cabrera, M., Cerecetto, H., González, M., Kratje, R., Raimondi, A., Oggero, M., & Bollati-Fogolín, M. (2020), Identification and characterization of human interferon alpha inhibitors through a WISH cell line-based reporter gene assay. Bioorganic chemistry, 94, 103372.
Espinosa-Bustos, C., Vázquez, K., Varela, J., Cerecetto, H., Paulino, M., Segura, R., Pizarro, J., Vera, B., González, M., Zarate, A. M., & Salas, C. O. (2020) New aryloxy-quinone derivatives with promising activity on Trypanosoma cruzi. Archiv der pharmazie (Weinheim), 353(1), e1900213.
González, A., Becerra, N., Kashif, M., González, M., Cerecetto, H., Aguilera, E., Nogueda-Torres, B., Chacón-Vargas, K. F., Zarate-Ramos, J. J., Salas Sánchez, C. O., Castillo-Velázquez, U, Rivera, G., & Vázquez, K.. (2020). In vitro and in silico evaluations of new aryloxy-1,4-naphthoquinones as anti-Trypanosoma cruzi agents. Medicinal chemistry research, 29, 665–674.
Musetti, B., González-Ramos, H., González, M., Bahnson, E. M., Varela, J., & Thomson L. (2020) Cannabis sativa extracts protect LDL from Cu2+-mediated oxidation. Journal of cannabis research, 2, 37.
Romero, A.H. & Cerecetto, H. (2020), A common, facile and eco-friendly method for the reduction of nitroarenes, Selective reduction of poly-nitroarenes and deoxygenation of N-oxide containing heteroarenes using elemental sulfur. European Journal of organic chemistry, 2020: 1853-1865.
Couto, M., Alamón, C., Nievas, S., Perona, M., Dagrosa, M. A., Teixidor, F., Cabral, P., Viñas, C., & Cerecetto, H. (2020). Bimodal therapeutic agents against glioblastoma, one of the most lethal forms of cancer. Chemistry A European Journal (Weinheim an der Bergstrasse, Germany), 26(63), 14335–14340.
Couto, M., Alamón, C., García, M. F., Kovacs, M., Trias, E., Nievas, S., Pozzi, E., Curotto, P., Thorp, S., Dagrosa, M. A., Teixidor, F., Viñas, C., & Cerecetto, H. (2020). Closo-carboranyl- and metallacarboranyl [1,2,3]triazolyl-decorated Lapatinib-scaffold for cancer therapy combining tyrosine kinase inhibition and boron neutron capture therapy. Cells, 9(6), 1408.
Aguilera, E., Perdomo, C., Espindola, A., Corvo, I., Faral-Tello, P., Robello, C., Serna, E., Benítez, F., Riveros, R., Torres, S., Vera de Bilbao, N. I., Yaluff, G., & Alvarez, G. (2019). A nature-inspired design yields a new class of steroids against trypanosomatids. Molecules (Basel, Switzerland), 24(20), 3800.
Bonifacino, C., Rodríguez, G., Pérez-Ruchel, A., Repetto, J. L., Cerecetto, H., Cajarville, C., & González, M. (2019). Identification of N-oxide-containing aromatic heterocycles as pharmacophores for rumen fermentation modifiers. Metabolites, 9(4), 62.
Couto, M., Alamón, C., Sánchez, C., Dávila, B., Fernández, M., Lecot, N., Cabral, P., Teixidor, F., Viñas, C., & Cerecetto, H. (2019). Carboranylanilinoquinazoline EGFR-inhibitors: toward ‘lead-to-candidate’ stage in the drug-development pipeline. Future medicinal chemistry, 11(17), 2273–2285.
Dávila, B., Sánchez, C., Fernández, M., Cerecetto, H., Lecot, N., Cabral, P., Glisoni, R., & González, M. (2019). Selective hypoxia-cytotoxin 7-fluoro-2-aminophenazine 5,10-dioxide: Toward “candidate-to-drug” stage in the drug-development pipeline. ChemistrySelect, 4(32), 9396-9402.
Dib, N., Fernández, L., Santo, M., Otero, L., Alustiza, F., Liaudat, A. C., Bosch, P., Lavaggi, M. L., Cerecetto, H., & González, M. (2019). Formation of dendrimer-guest complexes as a strategy to increase the solubility of a phenazine N, N’-dioxide derivative with antitumor activity. Heliyon, 5(4), e01528.
Ferraro, F., Merlino, A., Gil, J., Cerecetto, H., Corvo, I., & Cabrera, M. (2019). Cathepsin L inhibitors with activity against the liver fluke identified from a focus library of quinoxaline 1,4-di-N-oxide derivatives. Molecules, 24(13), 2348.
Hernández, P., Alem, D., Nieves, M., Cerecetto, H., González, M., Martínez-López, W., & Lavaggi, M.L. (2019). Chemosensitizer effect of cisplatin-treated bladder cancer cells by phenazine-5,10-dioxides. Environmental toxicology and pharmacology, 69, 9-15.
Soares, F. G. N., Göethel, G., Kagami, L. P., das Neves, G. M., Sauer, E., Birriel, E., Varela, J., Gonçalves, I. L., Von Poser, G., González, M., Kawano, D. F., Paula, F. R., de Melo, E. B., Garcia, S. C., Cerecetto, H., & Eifler-Lima, V. L. (2019) Novel coumarins active against Trypanosoma cruzi and toxicity assessment using the animal model Caenorhabditis elegans. BioMed central pharmacology & toxicology, 20(Suppl 1), 76.
Aguilera, E., Varela, J., Serna, E., Torres, S., Yaluff, G., Bilbao, N. V., Cerecetto, H., Alvarez, G., & González, M. (2018). Looking for combination of benznidazole and Trypanosoma cruzi-triosephosphate isomerase inhibitors for Chagas disease treatment. Memorias do Instituto Oswaldo Cruz, 113(3), 153–160.
Varela, J., Cerecetto, H., & González, M. (2018). Slowed Development of Natural Products for Chagas Disease, how to Move Forward? InTechOpen.
Cataldo, N., Musetti, B., Celano, L., Carabio, C., Cassina, A., Cerecetto, H., González, M., & Thomson, L. (2018). Inhibition of LDL oxidation and inflammasome assembly by nitroaliphatic derivatives. Potential use as anti-inflammatory and anti-atherogenic agents. European journal of medicinal chemistry, 159, 178-186.
Cerecetto, H.E., & Couto, M. (2018). Medicinal Chemistry of Boron-Bearing Compounds for BNCT- Glioma Treatment: Current Challenges and Perspectives. Glioma – Contemporary Diagnostic and Therapeutic Approaches. InTechOpen.
Couto, M., García, M. F., Alamón, C., Cabrera, M., Cabral, P., Merlino, A., Teixidor, F., Cerecetto, H., & Viñas, C. (2018). Discovery of Potent EGFR Inhibitors through the Incorporation of a 3D-Aromatic-Boron-Rich-Cluster into the 4-Anilinoquinazoline Scaffold: Potential Drugs for Glioma Treatment. Chemistry A European Journal (Weinheim an der Bergstrasse, Germany), 24(13), 3122–3126.
Couto, M., Mastandrea, I., Cabrera, M., Cabral, P., Teixidor, F., Cerecetto, H., & Viñas, C. (2018). Small-Molecule Kinase-Inhibitors-Loaded Boron Cluster as Hybrid Agents for Glioma-Cell-Targeting Therapy. Chemistry A European Journal (Weinheim an der Bergstrasse, Germany), 23(39), 9233–9238.
García, M. F., Gallazzi, F., Junqueira, M. S., Fernández, M., Camacho, X., Mororó, J. D. S., Faria, D., Carneiro, C. G., Couto, M., Carrión, F., Pritsch, O., Chammas, R., Quinn, T., Cabral, P., & Cerecetto, H. (2018).
Synthesis of hydrophilic HYNIC-[1,2,4,5]tetrazine conjugates and their use in antibody pretargeting with 99mTc. Organic & biomolecular chemistry, 16(29), 5275–5285.
Saramago, L., Gomes, H., Aguilera, E., Cerecetto, H., González, M., Cabrera, M., Alzugaray, M. F., da Silva Vaz Junior, I., Nunes da Fonseca, R., Aguirre-López, B., Cabrera, N., Pérez-Montfort, R., Merlino, A., Moraes, J., & Álvarez, G. (2018). Novel and selective Rhipicephalus microplus triosephosphate isomerase inhibitors with acaricidal activity. Veterinary sciences, 5(3), 74.